海昶生物HC016中美IND双告捷 全球创新肿瘤免疫疗法加速落地 | 达晨Family
发布日期:2025-03-10
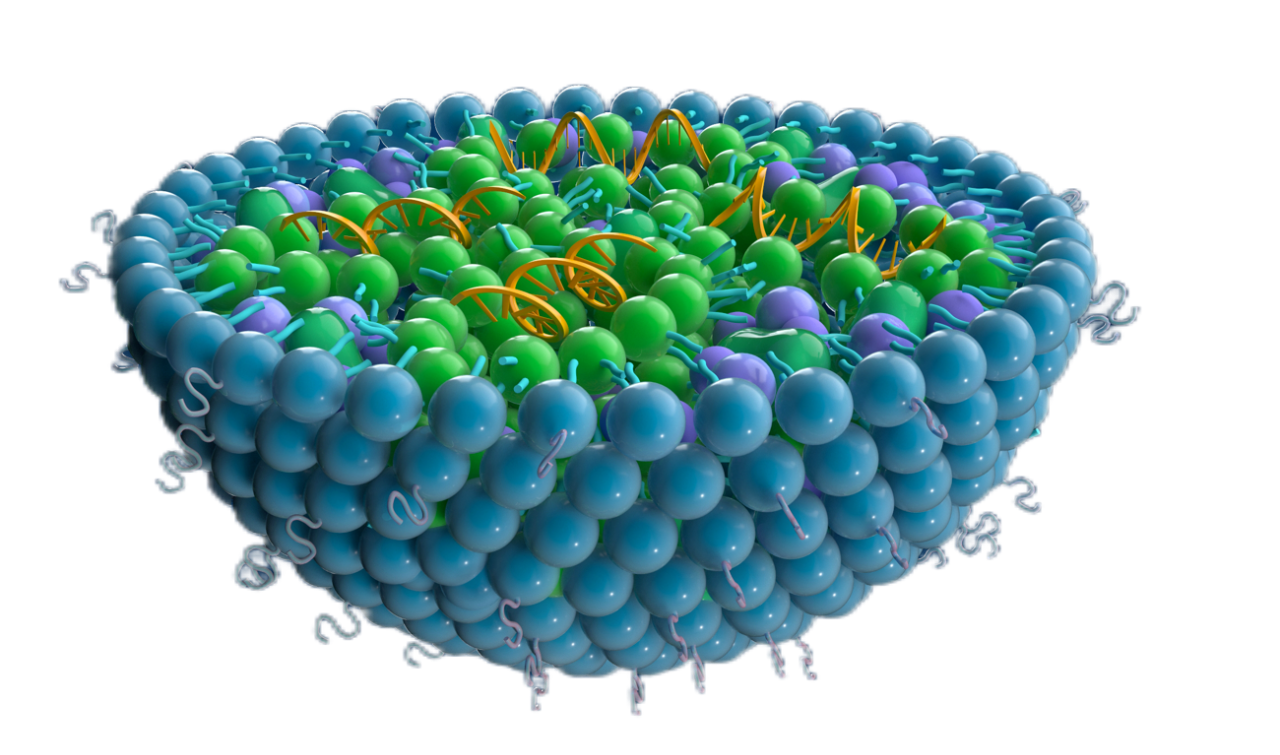
近日,达晨投资企业海昶生物自主研发的全球首款基于脂质纳米颗粒(LNP)递送技术的TLR9激动剂—HC016脂质复合物注射液,正式获得中国国家药品监督管理局(NMPA)临床试验(IND)批件。此前,该药物已于2025年1月18日获美国食品药品监督管理局(FDA)IND批准。至此,HC016成为国内首个实现中美双报双批的LNP递送TLR9激动剂项目,标志着这一突破性肿瘤免疫疗法进入全球同步开发阶段,为实体瘤治疗提供全新解决方案。海昶生物以药物递送系统开发和产业化为核心,专注于小核酸药物、mRNA疫苗等核酸创新药及复杂注射剂的开发。其自主研发的HC016,通过一种“精准快递”技术(QTsomeTM递送系统),把激活免疫系统的药物送到肿瘤内部,唤醒身体里的“警卫队”(如T细胞、巨噬细胞等)集中攻击癌细胞,同时减少对其他部位的误伤,还能追踪并消灭转移的“漏网之鱼”。此前,该药物凭借临床前研究中展现的显著肿瘤消退率、转移抑制效果及安全性数据,成为全球首个通过FDA审评的LNP递送TLR9激动剂项目。此次NMPA的高效批复,不仅验证了HC016的科学价值,更彰显中国创新药企在全球核酸药物赛道的前沿竞争力。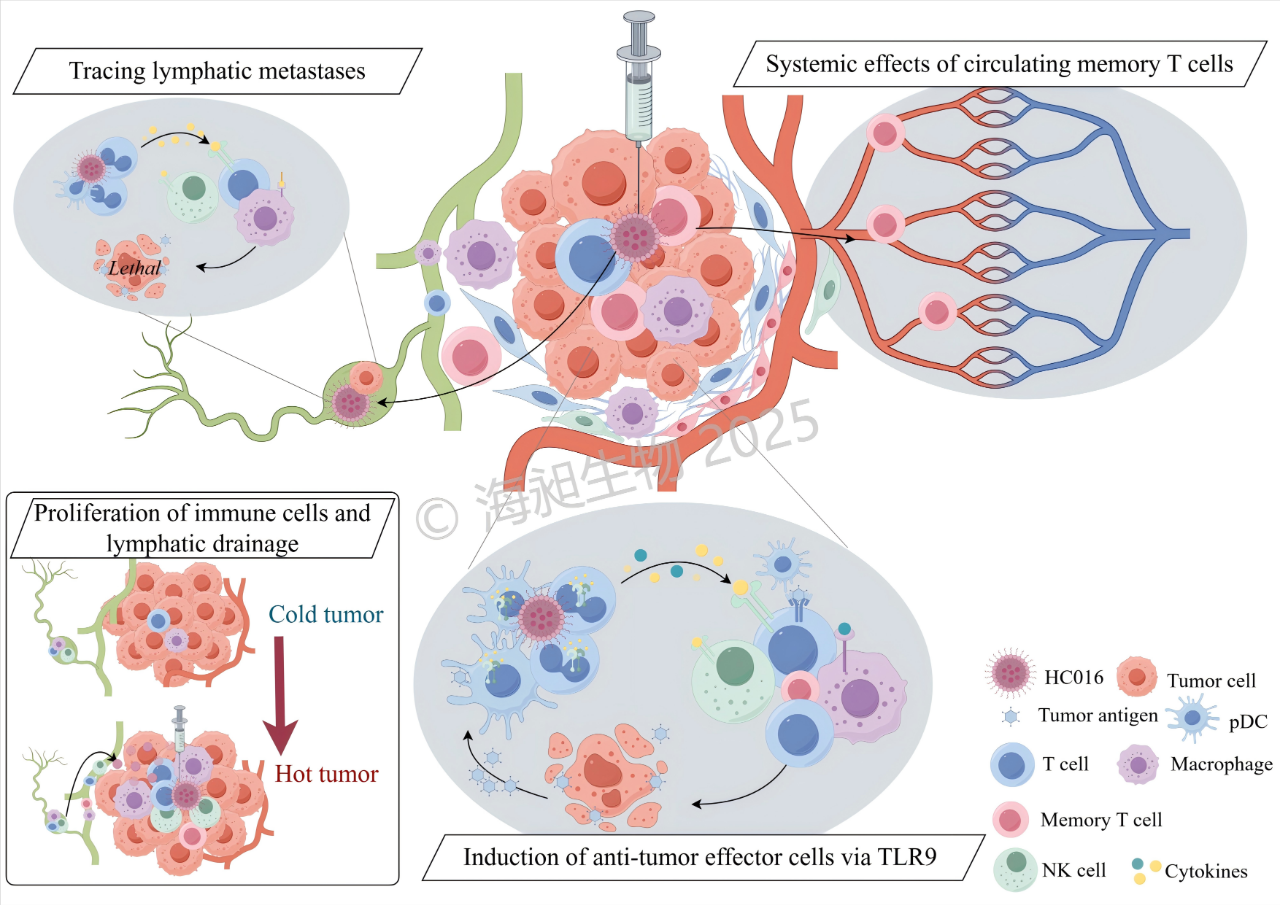 © 海昶生物 2025,版权所有,未经授权禁止商用
© 海昶生物 2025,版权所有,未经授权禁止商用| 突破技术瓶颈:从"系统性毒性"到"精准免疫激活"
传统TLR9激动剂因脱靶毒性高、肿瘤富集率低、单药响应率不足10%等痛点长期难以成药。HC016依托QTsomeTM技术实现三大突破性改进:
精准靶向递送:通过LNP载体实现药物在肿瘤组织的高选择性富集,显著降低对正常组织的脱靶效应,系统性毒性风险得到有效控制;
高效胞内释放:QTsomeTM技术针对性突破TLR9胞内作用机制,大幅提升药物递送效率并促进靶点激活,起效剂量较传统疗法实现数量级优化;
淋巴系统追踪:QTsomeTM特有的淋巴趋向性可精准覆盖肿瘤转移路径,同步清除原发灶与微转移病灶,临床前研究显示其具备广谱实体瘤治疗潜力。
作为国家级专精特新“小巨人”企业,海昶生物已构建覆盖小核酸药物、mRNA疫苗、复杂注射剂的三大战略管线。注射用紫杉醇(白蛋白结合型)在欧盟、中国、英国等40余国获批上市,HC0301小核酸药物完成中美双IND申报并进入全球II期临床,HC016项目中美双报IND获批。QTsomeTM技术已成功应用于新冠mRNA疫苗(FDA临床批件)、肿瘤免疫疗法(HC016)等领域,形成“一平台多管线”研发矩阵。随着中美临床试验的启动,海昶生物将系统评估HC016在晚期实体瘤患者中的安全性及疗效,并探索"泛肿瘤"适应症拓展路径。公司创始人赵孝斌博士表示:"HC016的全球化开发印证了核酸递送技术的临床转化潜力。我们正积极与全球临床中心及药企合作伙伴对接,务实推进临床研究,并开放合作引入战略伙伴,让这一‘中国智造’的创新疗法早日惠及患者。"





